

11. Thermodynamik der Gase, Phasenübergänge
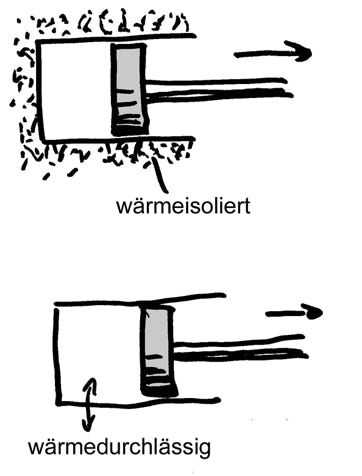
1. (a) Der Kolben in der oberen Abbildung wird nach rechts bewegt. Welche der Größen Volumen, Druck, Entropie und Temperatur ändern sich? Zu- oder Abnahme?
(b) Der Kolben in der unteren Abbildung wird nach rechts bewegt. Welche der Größen Volumen, Druck, Entropie und Temperatur ändern sich? Zu- oder Abnahme?
Lösung:
(a) Volumen nimmt zu; Druck nimmt ab; Entropie bleibt gleich; Temperatur nimmt ab.
(b) Volumen nimmt zu; Druck nimmt ab; Entropie nimmt zu; Temperatur bleibt gleich.
2. Normale Luft wird komprimiert bis ihr Druck 200 bar beträgt. Dabei wird dafür gesorgt, dass keine Entropie in die Umgebung abfließen kann. Welche Temperatur nimmt die Luft an?
3. Wie kann man es erreichen, dass die Temperatur eines Gases abnimmt, obwohl man ihm Entropie zuführt?
Lösung:
Eine Volumengvergrößerung bei konstanter Entropie führt zu einer Abnahme der Temperatur. Wenn man das Volumen hinreichend stark vergrößert, nimmt die Temperatur auch dann noch ab, wenn Entropie zugeführt wird.
4. Warum wird es in der Erdatmosphäre nach oben hin kälter?
Lösung:
Eine Luftportion, die aufsteigt, dehnt sich aus, ihre Entropie verteilt sich auf einen größeren Raumbereich. Dadurch sinkt die Temperatur. Eine Luftportion, die absinkt, wird komprimiert, ihre Entropie wird konzentriert, die Temperatur steigt. In einer gut durchmischten Atmosphäre ist die Temperatur oben niedriger als unten – genau so wie der Druck.
5. In zwei Behältern befindet sich die gleiche Menge des gleichen Gases bei gleicher Temperatur. Den beiden Gasen wird nun die gleiche Entropiemenge zugeführt. Bei dem einen wird dabei das Volumen konstant gehalten, bei dem anderen der Druck. Sind die Temperaturänderungen in beiden Gasen gleich? Wenn nein, in welchem ist die Temperaturänderung größer? Nimmt die Temperatur zu oder ab? Begründung.
Lösung:
Die Temperatur nimmt in beiden Gasen zu. In dem Gas, bei dem das Volumen konstant gehalten wird, nimmt sie stärker zu.
Den Prozess mit konstantem Druck kann man sich in zwei Einzelprozesse zerlegt denken. Im ersten Prozessschritt wird die Entropie zugeführt und das Volumen konstant gehalten (wie bei dem anderen Gas). Dann folgt einzweiter Schritt, bei dem sich das Gas ohne weitere Entropiezufuhr so weit entspannt, dass der Druck wieder gleich dem Ausgangsdruck ist. Dabei nimmt seine Temperatur ab. Seine Endtemperatur ist also niedriger als die Endtemperatur des anderen Gases.
6. Warum ist es besser, ein Getränk mit Eiswürfeln von 0 °C zu kühlen, als mit flüssigem Wasser von 0 °C?
Lösung:
Allein beim Schmelzen entzieht das Eis dem Getränk schon viel Entropie (etwa1200 Ct/kg).
7. Stelle in einem Diagramm den Zusammenhang zwischen Temperatur und Entropie von Wasser dar. Erkläre das Diagramm.
8. Was versteht man unter einem Phasenübergang? Skizziere den T-S-Zusammenhang für einen Bereich, der mindestens einen Phasenübergang enthält.
9. Erkläre den Unterschied zwischen den Vorgängen „verdunsten“ und „sieden“.
10. Wie viel Entropie wird gebraucht, um 50 g flüssiges Wasser von 100 °C in Wasserdampf
von 100 °C zu verwandeln?
Lösung:
1 kg Wasserdampf enthält 6000 Ct mehr Entropie als 1 kg flüssiges Wasser.
50 g Wasserdampf enthalten 300 Ct mehr Entropie als 60 g flüssiges Wasser.
11. Warum kann die Körpertemperatur durch Schwitzen reguliert werden?
12. Warum werden Speisen in einem „Dampfkochtopf“ in kürzerer Zeit gar als in einem normalen Topf?
13. Warum entstehen bei Verbrennungen mit heißem Wasserdampf von 100 °C schlimmere Verletzungen als bei Verbrennungen mit flüssigem Wasser von 100 °C.
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Aliquam tincidunt lorem enim, eget fringilla